金属碳化物作为一类具有很高熔点和硬度、良好热稳定性和机械稳定性、极好抗腐蚀特性的新型功能材料,已广泛用于各种耐高温、耐磨擦和耐化学腐蚀等领域。钼的碳化物除具 备上述金属碳化物的特性外, 还被发现具有类似贵金属的电子结构合催化特性,可广泛用于 有氢参与的反应如烷烃异构化、不饱和烃加氢、加氢脱硫和脱氮等反应的催化剂。下面就对碳化钼的性能、应用及制备方法作简要综述。
1 机械合金化制备碳化钼
1.1 微纳米 MoC 粉体的制备
实验方法:
将高能球磨机抽成真空,连续通入保护气体和反应气体CO,球磨介质为氧化锆陶瓷球,球料比为8:1,球磨时间为30h,所得的MoC粉末的平均直径为100nm。
试验结果:
球磨最终所得的产物是六方结构的MoC。球磨之前,XRD曲线为一组Mo的标准衍射谱。球磨初期,仅引起Mo的衍射峰的宽化。球磨10h后,由机械能引起的Mo与煤气的固态一气态 化学反应开始发生,有少量的MoC形成。随球磨时间的增加,MoC的含量也不断增加。球磨30h 后,原始粉末Mo衍射峰几乎全部消失,取代的是一组具有六方结构的MoC的衍射谱。原始钼 粉颗粒大小差别较大。随球磨时间的增加, 粉体颗粒逐渐细小均匀。球磨4h后粉体颗粒相比原始粉体要细小,而且大小分布均匀。球磨16h后由于颗粒的进一步细化,粉体出现团聚现 象。球磨30h后,粉体的平均颗粒尺寸接近纳米量级,同时仍有部分团聚颗粒出现。下测得的粉体的粒度大小。球磨4h后粉体的颗粒大小分布相对均匀, 颗粒尺寸也明显减小,平均粒 度在400nm左右。球磨30h后粉体变得更加均匀细小,粉体的平均粒度在100nm左右。
讨论 :
1)试验结果表明,通过金属粉末在煤气气氛中的高能球磨,在室温下即可实现金属的碳化反应,并形成亚微米级的金属碳化物粉体。这一技术为亚微米金属碳化物粉末的合成提供了一种新的途径。机械化学反应过程是以机械力的作用引起粉体性质和结构变化,机械能使 粉体发生晶型转变,并诱发化学反应。一般认为,在高能球磨过程中,粉末颗粒处于高能量 状态,在球与粉末颗粒发生碰撞的瞬间形成高活性区,并产生温升,可以诱发此处的化学反应。随球磨过程的连续进行,不断产生新鲜表面,从而维持了反应的进行l1l3J。在Mo与煤 气发生机械化学反应并生成亚微米碳化钼的过程中,能量是影响整个机械化学反应速率的重 要因素。煤气气氛中C原子的吸附与离解需要一定的能量,Mo—C化学吸附向Mo—C碳化物的转变, 也需要一定的能量激活;此外,原始钼粉颗粒的细化以及生成的碳化钼粉体颗粒的进 一步细化也同样需要能量维持。因此要保证机械化学反应的进行外界必须提供足够的能量。本试验中能量是通过搅拌轴的转动进而带动介质球和粉末之间的碰撞传递到粉末体中,因此提供能量的大小主要取决于搅拌轴转速的高低,不同的转速提供不同的机械能。在球料比为8:1的情况对较低的情况下不同球磨时间样品的x射线衍射下,经过30h球 磨,粉体平均粒度在100nm左右。
2)在Mo与煤气气氛的高能机械化学反应过程可见,虽然转速相差200r/min,但对机械化学反应过程却有很大的影响。在这种相对的低转速下直到球磨12h后Mo与煤气的固态一气 态化学反应才开始进行。球磨22h后与高速球磨16h后的机械化学反应情况相当。经过30h球 磨后,高速下固气化学反应基本完毕,而低速下的反应只完成了86%左右。因此,Mo在煤气气氛下的高能机械化学反应过程中,转速对反应速度有很大的影响。
结论:
本试验利用自行设计的高能机械化学球磨机,在室温下通过钼粉在煤气气氛下高能球磨得到中,球磨转速的高低对反应的速度起着重要作用。
1.2 超微细Mo2C和 MoC
试验方法:
章桥新等人利用机械合金化方法将钼粉和碳黑粉末分别按原子比2:1和1:1混合成功的制成了超微细的Mo2C和MoC化合物。
试验讨论:
发现合金的MA过程和产物与球料比密切相关。球料比50:1时两种合金均表现为混合、非晶化、结晶化三个阶段;20:1 时无此现象,但两种球料比下的产物均为MoC相;70:1时2Mo-C系合金的产物为Mo2C相。
应用实例:
MoC金属陶瓷粉体的应用之一是可以作为结构涂层材料.为此,利用等离子喷涂方法在基体材料上涂形成金属陶瓷涂层,粘结金属为常用的Ni60金属合金喷涂粉,在其中加入不同质量分数的微纳米MoC粉体,所喷涂粉料在基体材料上利用等离子喷涂设备形成涂层。基体材 料为40Cr钢,涂层磨损试验表明涂层耐磨性能有很大的提高,除此之外还被广泛用于机械、航空航天、石油化工以及电子电器等领域。
创新亮点:
首先利用机械合金化的方法制碳化钼在常温下就能进行,大大的节省的能源,是一个值得研究的方向。其次,用此方法得到的碳化钼粉末较为细,具有高的比表面积,有较大的应用前景。
2 气相法制备碳化钼
2.1 制备:气相法一般采用高比表面的活性炭(比表面积大于 200 ㎡/g)和过渡金属挥发性化合物,以化学计量比例投料到流动的反应器中,在 900~1400℃高温下反应一定时间,在惰性气体中冷却并回收碳化物的工艺过程。将高比表面碳和MoO3混合物在氩气中加热到800℃, 使MoO3升华吸附在碳上,并升温到1300℃反应一定时间制得Mo2C。有报导以MoO3和1150㎡/g 碳以 C/Mo 摩尔比为6:1进行反应可得六晶系的Mo2C,其比表面可达213㎡/g。化学气相沉积法通过让钼的金属氧化物或者金属在高温下气化后再与碳化气反应来获取碳化物。Leclercq 等将挥发性的金属化合物蒸发到含有低压碳氢化物的容器中,在高温下直接 碳化制得成碳化物。通过改变反应器中的气体组成和金属化合物前体的种类制得不同的碳化 物和碳氧化物。Nagai 等人利用该方法在 973K 真空条件下制备了活性较浸渍法高 3 倍的 Mo2C/Al2O3 催化剂。但这种方法的缺点是条件不易控制,合成量小。
2.2 应用:此种方法制得的碳化钼较多的应用于材料改性领域, 主要是因为其具有较高熔点和硬度、良好的热稳定性和机械稳定性、极好抗腐蚀特性等特点。它可以作为涂层材料使用,也可以作为添加材料使用。另外,碳化钼可以和碳化钨混合,加入适当的镧系,烧结成硬质合金生产方法,可以得到粘结相分布良好、致密和细化的碳化钼基硬质合金。碳化钼还可以添加到金属陶瓷中,以改善其性能。此外,碳化钼还通常用于颗粒增强合金。
2.3 分析:气相沉积法相对以前的高温加热法而言,在提高比表面积方面有所改进。但此种方法的不足在于制备过程所需温度较高,不能用于复杂外形的机件和细散的材料上镀覆,需要高价的设备等。
3 离子熔融法制备碳化钼
3.1 制备:离子熔融法是将钼酸盐和碳酸盐在电解容器中电解,通过电解还原中钼和碳的共沉积来形成碳化钼涂层的,较好条件下可在金属上形成100um厚的光滑镀层。热力学分析表 明:钼化钠、钼化锂和碳酸钠、碳酸锂具有最接近的分解势能。在电解还原中钼和碳可以共沉积,并有碳化物的形成。电解在MYIF-7石墨容器内进行,为防止容器氧化,将其放在氩 气流的刚玉试管内,用事先经干燥处理的试剂来制备溶液。电解质事先在负极电流1O~1·5·102A/㎡ 中进行电解处理,这样可以稳定持续的得到沉淀物。导电金属的负极使用了石墨、镍片、铜片、钢片。非导电物—分散的金刚石、碳化硅和碳化硼磨粉装在镍的容器内。正极使用石墨容器。
3.2应用:用离子熔液电解法使碳化钼在金属材料、金刚石、碳化硅和碳化硼颗粒上电镀层的沉积。电镀层可以提高金属材料的抗磨损, 研磨和破坏性能,提高其湿润性和金刚石、碳化硅和碳化硼的工作效率。节省了超硬材料。
3.3分析:离子熔融法弥补了气相沉积法制备过程中所需温度较高,不能用于复杂外形的机件和细散的材料上镀覆, 需要高价的设备等不足。此种方法的镀层速度主要取决于电解温度和负极电流。密实的Mo2C沉淀物的制成温度为8OO- 950℃(温度越高,沉淀物中的颗粒越紧实)。但在800℃时,碳化物层的厚度小于10um,沉淀物与底板结合的强度很低;在温度为750—800℃下,会脱落粉状的碳化物残渣。电解条件对碳化钼沉淀物及结构是有影响:结合性好、均匀密实、绝无孔隙度的镀层是在负极电流密度为1.0×102~1.0×103A/㎡的条件下制得的。在沉淀的初始阶段,沉淀物中晶体越少,电流密度越大。当电流密度大时,可以观察到颗粒大量地进行合并,而导致镀层粗糙度的增加。在电流密度为1.0×102A/㎡的情况下,镀层的粗糙度减小了,显然,是由于它的结合力减弱了。当电流密度大于10×102A/ ㎡时,底板的腐蚀速度高于沉淀晶体的速度,结合性好的镀层便无法制得。此外,反应物的浓度对碳化钼的制备也有影响。所以,严格控制反应条件是关键。
4 浸渍法制备碳化钼
4.1 制备:采用浸渍法制备碳载钼前驱体:用计量的乙酰丙酮合钼 MoO2(acac)2 (Sigma-Aldrich)水溶液浸渍Vulcan XC-72碳黑(简写 VC). 在 80 ℃ 下搅拌浸渍5h后, 于110℃烘干12h, 制得碳载钼前驱体MoO2(acac)2/VC. 再将0.2 g MoO2(acac)2/VC 装填至立式石英管式炉里, 在氩气气氛下, 从室温以5℃/min 升温至800℃, 并在800℃恒温2h. 然后缓慢冷却至室温后即得催化剂, 记为Mo2C/VC。
4.2应用:Mo2C/VC在燃料电池中具有类似 Pt/C的催化性能, 不仅可用于氢气的电催化氧化反应, 也可用于阴极的氧还原反应。另外,碳化钼已经应用于催化加氢、催化脱氢、催化加氢脱硫、催化加氢脱氮、异构化、氨的分解和芳构化等过程。
4.3分析: Mo2C/VC样品的体相为β-Mo2C. 由于Mo2C极易与氧发生反应, 在Mo2C制备过程中又无法完全除去氧, 样品表面结构与体相可能不同, 存在表面吸附氧并形成氧化物. Mo2C/VC的电催化性能可能是由其表面钝化物种(MoOxCy 和 MoOz)的氧化还原, 以及Mo2C晶格氧的迁入迁出引起的。
另外,通过等离子体溅射方法也是能获得碳化物甚至纳米级颗粒。钼系纳米材料的研究为钼的新应用构建了广阔空间,与传统的“大块”钼材料相比,纳米材料的性能奇特,应用广泛,例如纳米钼肥,可渗透植物根系的各个部位,从而使其肥效高且持久。
5 程序升温还原法制备碳化钼程序升温还原法是以过渡金属氧化物与烃和氢气混台物为原料,经过类似于程序升温还原过程的工艺,可在设定温度下进行,使过渡金属氧化物经过还原和碳化台(渗碳)的反应过程。常用的烃有甲烷、乙烷、乙烯,作为碳源也可以用CO、CO2。反应温度一般在400~1000℃ 范围内,所制备出的碳化物的比表面从几个到200㎡/g 。
早期碳化钼和氮化钼的合成主要是采用高温加热反应法,但合成的碳化钼的比表面积一 般都很小。
80年代发展的程序升温反应方法(temperature— programmed reaction) 为高比表面 积碳化物和氮化物的合成开辟了一条新的途径。这种方法中一般采用金属氧化物作为前驱物,还原气体一般采用20vo1%CH2—80vo1%H2的混合气体或者纯NH3。在反应过程中严格控 制升温速率和气体流速,使得反应中催化剂的烧结与合成的速率达到了较好平衡, 因此得到的样品具有较大的比表面。Volpe J和Oyama 等分别用此方法制得了比表面积达50—90㎡/g的β-MoC。
5.1实验
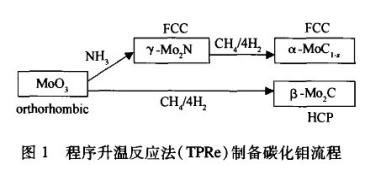
实验例一:碳化钼制备采用程序升温反应法(TPRe),具体方法为,将一定量的MoO3装入石英反应管,置于管式炉中。β-Mo2C的制备以n(CH4)/n(H2)=1/4的混合气为碳化介质直接碳化,空速在15000h-1左右。采用两段程序升温控制,室温到673 K段升温速率为5 K/min, 673 K后升温速率为1 K/min;而仅α-MoC1-x的制备则先以NH3氮化后再碳化完成。最后在Ar中快速冷却至室温,然后采用含微量氧的O2/N2混合气钝化即得样品,具体流程见图1。
实验例二:纯的Mo2C和担载的Mo2C样品是参照Boudart等人提出的程序升温反应方法制各的。MoO3是利用钼酸铵(A..R.)在500℃加热4h分解制得,氧化铝担载的MoO3是用按计量配好的 铝酸铵(A.R.)-氨水溶液浸渍工业氧化铝载体(20~40目.抚顺石化研究院),搅拌30min室温放置过夜,然后在50℃水浴中放置4.5h加热至干,转入烘箱(110℃)烘约13 h,再用马弗 炉在500℃焙烧4 h制得催化剂的前躯体MoO3。称取2.1 g (约3 mL)前躯体于多功能催化剂评 价装置(KY-1020D型,姜堰市科苑电子仪器有限公司)的反应管中,常压下氢气流速为270.8 mmol/h。按不同的碳化终温和不同碳化进料速率, 以lK/min程序升温至碳化终温,并恒温2h后快速冷却至室温,用含O2 1%的N2气流钝化6h,制得研究用的Mo2C催化剂。
实验例三:实验用氧化钼由钼酸铵于马弗炉中 550oC 焙烧4h制得;碳化钼由相应的氧化物前驱体经压片、筛分后置于自制的还原碳化实验装置中,在体积空速为6×100h的CH4/H2气氛中程序升温至给定温度,恒温3h,快速冷却至室温,用含1%02的N2气流室温钝化3h制得。

5.2 分析
例1中:
由MoO3制得碳化钼的时间表:
| 第1段程序升温 | 第2段程序升温 | |
| 升温范围 | 298k-650k | 650k-950k |
| 速度 | 5k/min | 1k/min |
| 时间 | 70min | 300min |
例2中:
制MoO3所用的时间表:
| 时间 | 制 MoO3 总时间 | 制碳化钼反应时间 | |
| 纯 MoO3 | 4h | 4h | 升温到 600 度 10h+恒 温 2h+纯化 6h=18h |
| 氧化铝担载的 MoO3 | 30min+12h+4.5h+13h+4h | 34h |
例3中:
MoO3在CH4/H2气氛中进行程序升温还原碳化反应,可以转化为Mo2C,其反应历程可表示为MoO3一Mo02一Mo0xCy一Mo2C,适宜的反应温度应在675oC左右。碳化钼样品表面Mo/C比为0.95,小于Mo2C的理论原子比2,是因为样品表面多余的碳,使表面比过低。
从两表中可以看出在制备Mo2C过程中大部分时间用于制备MoO3,在通过氧化铝担载的MoO3制备Mo2C的过程中制备MoO3的时间甚至占74%。可以看出制备Mo2C的过程中准备工作过于繁杂。分析例一、例二和例三两实验的产物,知面Mo2C 的产率比较低,而且杂质比较多,提纯相对困难,对表面比的控制也不易。所以若要推广碳化钼的应用,必然要解决两个问题:
一、简化碳化钼原料制备的问题;
二、缩短碳化钼制备的时间,提高反应率。
则可以从以下几方面改进:
1、 简化MoO3的制备过程
2、 寻找MoO3制备Mo2C反应的催化剂
3、 针对不同用途采用不同的制备方法
5.3 程序升温制备的碳化钼的应用:
1、 例二中载体表面所形成的碳化物晶体是很单薄的一层晶膜,以致用XRD检测不出碳化物的特征峰,这也可以说明实验所用的碳源的制备方法能够制各出高分散性的催化剂。
2、 对比不同的碳化钼制备方法, 程序升温法的表面整体较高。并且可以按不同的配料比调整表面比。
3、 采用程序升温还原法可以制备比表面在 50~lOOm2/g 六方晶系的Mo2C粉技术。研究表明不同的制备工艺可得到不同化学组成的MoC1一 x (0≤X≤0.5)和不同晶态的碳化钼。
5.4 总结:
实验室制各碳化铝催化剂通常都采用Boudart等人开发的程序升温碳化的方法,用该方法可以选择的原料很多,但目前主要使用的碳化原料是甲烷和氢气的混合物,也有使用乙烷、乙炔、丙烷和丁烷的少量报道。采用这些物质作为碳源时,通常需要较高的碳化温度,故制各碳化钼仅限于高温碳化物。从碳化物的形成机理来看,烃脱氢之后析出碳的过程对碳氧化物 和碳化物的形成具有重要影响,即相对来说容易析碳的烃在一定程度 对碳化物的形成具有 促进作用。事实上,从以不同碳源制备碳化物的结果来看,较长链的烃表现出了更高的反应活性.因而碳化所需的温度也相对较低。考虑到该催化剂的大摄制备,采用液态有机原料作 为碳源则会使操作方便得多。同时人们对于C6作为碳化原料的研究还很少。
6 碳化钼应用
6.1材料改性
碳化钼应用于材料改性领域,主要是因为其具有较高熔点和硬度、良好热稳定性和机械稳定性、极好抗腐蚀特性等特点。它可以作为涂层材料使用,也可以作为添加材料使用。
碳化钼通常作为涂层材料用于一些高硬度、耐磨擦和耐高温等领域。
碳化钼(MoC)和碳化钨混合,加入适当的镧粉,烧结成硬质材料,经粗碎后加入一定的镍,采用通常的硬质合金生产方法,可以得到粘结相分布良好、致密和细化的碳化钼基硬质合金 。碳化钼还可以添加到金属陶瓷中,以改善其性能。此外,碳化钼还通常用于颗粒增强合金。
6.2 催化材料
碳化钼具有贵金属的某些性质,对于烃类脱氢、氢解和异构化反应的催化活性,可与贵金属铂、铱相媲美,被誉为“准铂催化剂”。尤其是其价格较贵金属低廉且又具有优良的抗 硫中毒性能,使得其在催化剂领域的有着广阔的应用前景。碳化钼作为优良的催化材料,必须具备高的比表面积。
7 结 语
金属碳化物是一类具有高硬度、高熔点、良好热稳定性和抗腐蚀性的新型功能材料,已在许多领域得到应用。近年来,碳化物尤其是碳化钼作为一类新型催化材料已引起研究者的广泛关注。就其催化特性而言,碳化钼在许多方面与铂族贵金属相似,特别是其加氢活性上与Pt、Pd等贵金属相当,有望成为贵金属的替代物。文献表明,碳化钼在诸多催化领域中均表现出了独特的性能,展示了这类催化新材料潜在的应用前景。